姜鹏关新元吴健生合作开发癌症免疫大数据引擎揭示基于分泌蛋白的新免疫疗法
分泌蛋白是细胞间通讯的中枢介质,可以作为多种疾病的治疗靶点。编码分泌蛋白的1903个人类基因很难通过常见的遗传方法进行研究。
2025年7月28日,美国国家癌症研究所 (NCI) 姜鹏、香港大学关新元、药明生物吴健生共同通讯((龚兰奇、罗洁为共同第一作者))在Cell在线发表题为“Cancer immunology data engine reveals secreted AOAH as a potential immunotherapy”的研究论文,该研究首次系统解析了人体中1900余种编码分泌蛋白的基因在肿瘤免疫微环境中的调控作用。
该研究开发了癌症免疫学数据引擎(CIDE,,该研究整合了90个组学数据集,涵盖8575个肿瘤特征和17种实体瘤类型的免疫治疗结果。CIDE系统地鉴定了与免疫治疗结果相关的所有基因。然后,将重点放在不具有已知癌症作用的CIPG电子网站DE优先考虑的分泌蛋白上,并在小鼠模型中验证了对AOAH、CR1L、COLQ和ADAMTS7免疫检查点阻断的调节作用。最受欢迎的酰氧酰基水解酶(AOAH)通过使T细胞受体对弱抗原敏感,并通过消耗免疫抑制性花生四烯酸磷脂酰胆碱和氧化衍生物来保护树突状细胞,从而增强多种肿瘤模型中的免疫疗法。

分泌的蛋白质,如细胞因子、生长因子和可溶性酶,介导广泛的功能,包括细胞间PG电子网站信号传导和免疫反应。尽管研究历史悠久,但基于分泌蛋白的抗癌疗法有许多局限性。例如,很少有患者对工程化IL-2表现出客观反应。同样,抗细胞因子疗法往往无法带来临床益处,如胶质母细胞瘤中的抗血管内皮生长因子(VEGF)和触发超进展的抗转化生长因子β(TGF-β)/程序性死亡配体1(PDL1)。这些治疗限制的根本原因是缺乏对癌症分泌蛋白功能的系统知识。人类基因组包含约1903个编码分泌蛋白的基因,但其中61%的基因在文献中没有报告与癌症相关的功能。大多数关于分泌蛋白的基础和治疗研究都集中在约100种已知的细胞因子上,如IL-2、IL-15、VEGF或TGF-β,而大多数分泌基因尚未探索。
使用CRISPR、短发夹RNA(shRNA)或开放阅读框技术的混合遗传筛选一直是揭示基因功能的主要方法。然而,这种池化策略对于研究分泌蛋白无效,因为附近没有基因敲除的细胞仍然可以分泌蛋白质并补偿分泌蛋白在邻近细胞中的扰动。混合方法的另一种选择是阵列遗传筛查,它通过体外检测来询问分泌蛋白的功能。然而,这些方法缺乏生理背景,因为分泌蛋白通常与组织生态系统中的其他因素相互作用。
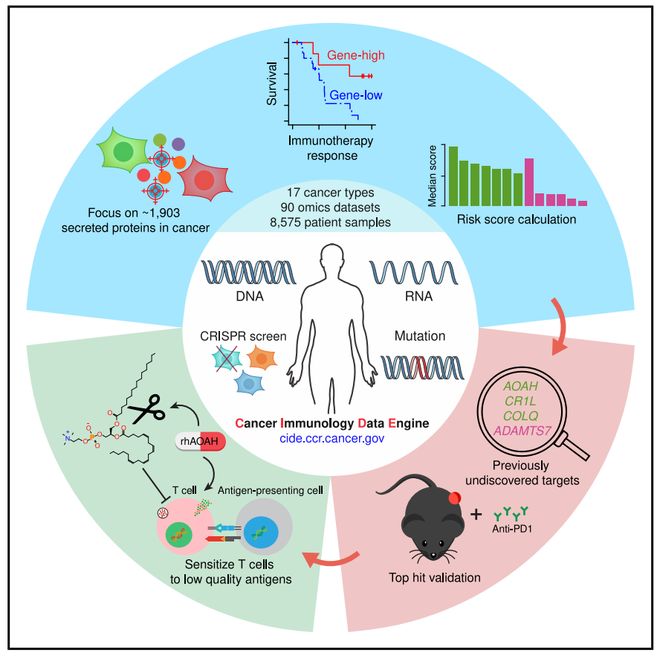
在这里,研究人员利用免疫生态学临床研究的大量组学数据开发了一种数据驱动的解决方案。许多分泌蛋白(如细胞因子)的主要功能是调节免疫反应。因此,该研究建立了癌症免疫数据引擎(CIDE),并优先考虑了预测可促进或抑制多种肿瘤类型免疫疗法反应的分泌蛋白。依托体内外模型,该研究进一步发现,酰氧酰基水解酶(AOAH)能特异性清除免疫抑制性卵磷脂及其氧化产物,解除肿瘤免疫抑制,显著增强T细胞受体识别弱抗原的能力并保护树突状细胞的抗原递呈和共刺激功能。该研究同时鉴定出CR1L、COLQ和ADAMTS7等潜在新调控因子和靶点,为实体瘤免疫治疗开辟全新路径。





